
[e경제뉴스 노영조 기자] 보령제약의 전이성 소세포폐암 치료제 '러비넥테딘' 등 7종이 희귀 의약품으로 새로 지정됐다.
러비넥테딘이 지정받은 적응증은 '1차 백금포함 화학요법에 실패한 진행된 전이성 소세포폐암 성인 환자의 치료'다. 해당 질환은 폐암 중에서도 공격적 성향이 강하고 치료 후 재발률도 높은 것으로 알려져 있다.
러비넥테딘은 지난 6월 미 식약국(FDA)으로부터 기존 치료제와의 비교를 통해 안전성, 유효성에서의 우월성을 입증한 2상임상 결과를 인정받아 3상 조건부 신속승인(accelerated approval) 및 우선 심사(priority review) 승인을 획득했다.
현재 원개발사인 스페인 파마마가 글로벌 임상3상을 진행 중이다.
러비넥테딘 국내 개발 및 판매 독점권은 보령제약이 갖고 있다. 보령제약은 지난 2017년 스페인 파마마사로부터 기술도입 계약을 맺었다.
보령제약은 올해 안으로 국내 허가를 신청할 예정이며, 승인이 완료되면 내년 중으로 러비넥테딘을 판매할 계획이다.
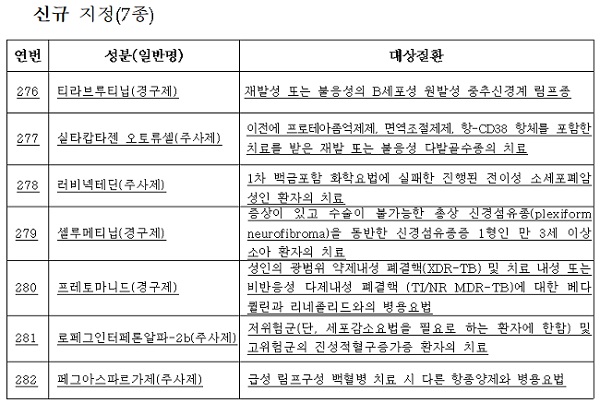
식약처는 또 비정형 용혈성 요독 증후군(aHUS) 등에 쓰이는 '에쿨리주맙'의 치료대상에 시신경 척수염 범주 질환(NMOSD)을 추가하는 등 희귀의약품 2종의 대상 질환을 확대하고 개발단계 희귀의약품 'PBP1510' 1종을 진행성 췌장암 치료용으로 지정해 공고했다.
개발단계 희귀의약품은 국내 임상시험 단계에 있는 희귀질환치료용 의약품을 말한다.
식약처는 희귀·난치질환 치료제의 개발을 지원하기 위해 희귀의약품에 대해 우선 허가하고 질환의 특성에 따라 허가 제출자료·기준 및 허가 조건 등을 따로 정할 수 있도록 '희귀의약품 지정 제도'를 운영하고 있다.
